
a. 正常b. saddleback c. coved
d. heterogeneous loss of AP dome e. phase 2 reentry
活動電位
V2 誘導
V2 誘導
活動電位
M細胞
心外膜
心内・外膜
電位差内・外膜
電位差
心内膜
心外膜心内膜
心外膜
心内膜
J 波
心内・外膜
電位差内
心内膜
心外膜
心内膜
心外膜
心外膜
心内・外膜再分極差
隣接心外膜再分極差
d. heterogeneous loss of AP dome e. phase 2 reentry
活動電位
V2 誘導
V2 誘導
活動電位
M細胞
心外膜
心内・外膜
電位差内・外膜
電位差
心内膜
心外膜心内膜
心外膜
心内膜
J 波
心内・外膜
電位差内
心内膜
心外膜
心内膜
心外膜
心外膜
心内・外膜再分極差
隣接心外膜再分極差
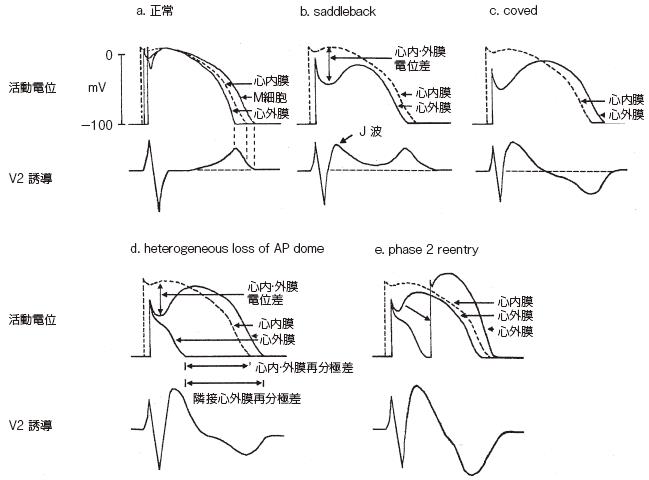
4.2 特徴的心電図を呈する機序
心外膜側心筋細胞と心内膜側心筋細胞の活動電位波形を比較すると,脱分極は心内膜側細胞で早期に生じ,再分極は心外膜側で早期に終了する.したがって,
APD は心内膜側細胞で延長している.さらに活動電位第1 相のノッチ形成に違いがある.心外膜側心筋細胞では第1 相にノッチを認めるのに対して,心内膜側心筋
細胞ではノッチを認めない.ヒトを含めた多くの動物で,このノッチ形成には一過性外向きK+ 電流(Ito)が直接的に関係する.Ito は同じ心外膜側心筋細胞でも,左室
に比べて右室,とくに右室流出路で豊富である.また,ノッチ形成には,第0 相脱分極に関与するNa+ 電流やノッチに引き続くドームの形成に関与するL 型Ca2+ 電流
も間接的に影響する.Ito や他の外向きK+ 電流である遅延整流K+ 電流(Ik),ATP 感受性K+電流などの増加,あるいは内向き電流(Na+,Ca2+)が減少した場合
には,心外膜側心筋細胞のノッチがさらに深くなり,引き続くドーム形成に影響を及ぼす.心内膜側の細胞ではこのような変化は起こらない.
したがって,正常状態の右側胸部誘導ではST 部分はほぼ基線に記録される(図2a)が,心臓の活動電位の立ち上がり(脱分極)に大きく関与するNa+ 電流の抑制
(loss of function)があると,Ito と拮抗することができないため心外膜側心筋細胞のノッチが深くなる.その結果,心外膜側心筋細胞でいわゆるスパイクアンドドーム
の形状が顕著となる.この際,電位勾配によりST の上昇(J 波)が認められるが,心外膜側心筋細胞のAPD 延長が軽度で,心内膜側細胞のAPD より短いままであ
れば,saddleback 型ST 上昇となる(図2b).さらに,内向き電流が減少するとノッチは大きく深くなり,これに続くドーム部分が遅れて心外膜側細胞で活動電位の再
分極が心内膜側より遅れる.この結果,上に凸のST 上昇に続いてT 波の終末部は陰性化する(図2c).この形状がBrugada 症候群に特徴とされるcoved 型ST 上昇
である.ノッチがさらに深くなり,Ca2+ 電流の流入が不活化されるとドームが消失する(loss of dome).これらのドームの遅延や消失は,再分極時間の大きな不均一
性から(図2d), phase 2 reentry が生じる(図2e).
図2 Brugada 症候群において推定される心電図変化の機序
(Antzelevitch C. J Cardiovasc Electrophysiol 2001; 12: 268-272 より改変)
(Antzelevitch C. J Cardiovasc Electrophysiol 2001; 12: 268-272 より改変)
II. 総論 >
4. Brugada症候群の発生機序 >
4.2 特徴的心電図を呈する機序

【ダイジェスト版】
QT延長症候群(先天性・二次性)とBrugada症候群の診療に関する
ガイドライン(2012年改訂版)
Guidelines for Diagnosis and Management of Patients with Long QT Syndrome and
Brugada Syndrome( JCS 2012)
ガイドライン(2012年改訂版)
Guidelines for Diagnosis and Management of Patients with Long QT Syndrome and
Brugada Syndrome( JCS 2012)